Introducción
El melanoma es un tipo de neoplasia que aparece cuando los melanocitos sufren una transformación maligna. En el 75% de los casos se desarrolla de novo, mientras que en el 25% restante lo hace sobre un nevus, o lunar, preexistente1. A pesar de que el 90% de los melanomas se originan en la piel, también pueden crecer en las superficies mucosas o en otros lugares a los que hayan migrado las células de la cresta neural, como la vulva, la vagina, el recto, el canal anal, los senos nasofaríngeos o la retina2.
En Europa, la incidencia de melanoma maligno varía entre 3 y 5 casos por 100.000 habitantes al año en la zona mediterránea, y hasta 12-25 en los países nórdicos3, con un incremento anual desde 1995 hasta 2002 del 4-7,7% en los hombres y del 3-6,3% en las mujeres4. La media de edad en el momento del diagnóstico se sitúa en torno a los 57 años5. La tasa de mortalidad mundial por melanoma está en 1,3 por 100.000 en los hombres y en 0,9 por 100.000 en las mujeres, y representa el 0,6% de las muertes por cáncer6.
El melanoma se presenta predominantemente en adultos. Aunque puede surgir en cualquier lugar de la superficie cutánea, en las mujeres se presenta con mayor frecuencia en las extremidades inferiores, y en los hombres en el tronco, la cabeza y el cuello, o en las extremidades superiores7.
Existen 3 grupos de factores de riesgo que predisponen al desarrollo de melanomas: propios del paciente, ambientales y genéticos. La detección precoz del melanoma es un elemento clave para la supervivencia a largo plazo. Así, en los pacientes con una patología localizada y tumores primarios con un espesor <1 mm, la supervivencia a largo plazo supera el 90%8. No obstante, más importante incluso que la detección precoz es la prevención del melanoma y de otros cánceres de piel evitando la exposición prolongada al sol y la irradiación por rayos ultravioleta, usando ropa adecuada y examinando la piel para detectar posibles cambios en cualquier lunar existente o la aparición de lesiones cutáneas nuevas, por lo que si esto ocurriese se debe consultar al médico9.
Inmunosupresión y cáncer de piel
Los trasplantes de órgano sólido mejoran, sin duda alguna, la supervivencia de los pacientes. Sin embargo, el uso de inmunosupresores a largo plazo, para evitar rechazos, aumenta el riesgo de desarrollar cáncer de piel10-12. La incidencia del melanoma en los pacientes postrasplantados parece ser mayor que en la población general, con una incidencia 2-10 veces superior11. En este sentido, existen factores de riesgo específicos en los pacientes trasplantados, como la magnitud de la inmunosupresión (dosis, tiempo y tipo), la edad en el momento del trasplante, los trasplantes previos, el fototipo y el tipo de trasplante, entre otros. Cabe mencionar que los trasplantes pulmonar y cardiaco son los que conllevan una mayor aparición de melanoma12. Por este motivo, el manejo de la inmunosupresión postrasplante constituye un paradigma complejo, en el que se deben tener en cuenta varios factores para la toma de decisiones.
A continuación se expone un caso que muestra los riesgos de la inmunosupresión farmacológica postrasplante prolongada en el tiempo, su posible relación con el desarrollo del melanoma maligno, y la dificultad del abordaje fármaco-oncológico en este grupo de pacientes.
Presentación del caso
Mujer de 59 años, sin alergias medicamentosas conocidas, con calendario vacunal actualizado, exfumadora, sin exposición solar laboral, UVA artificial o radioterapia (RT) previa. Como antecedentes de interés cabe citar que la paciente se sometió a un trasplante bipulmonar en enero de 2016 debido a una enfermedad pulmonar obstructiva crónica (EPOC) tipo enfisema, y que presentó como única complicación una trombosis venosa poplítea secundaria a la intervención quirúrgica, que se resolvió sin secuelas posteriores.
El tratamiento farmacológico habitual de la paciente consta de la pauta siguiente: tacrolimús retard 6 mg/24 h v.o., con unos niveles objetivo de 7-8 ng/mL; micofenolato de mofetilo 1.000 mg/12 h v.o.; metilprednisolona 8 mg/24 h v.o.; ácido fólico 5 mg/24 h v.o.; ácido alendrónico 70 mg/semana v.o.; acenocumarol v.o., según controles con Hemostasia; insulina glargina 16 U/cena s.c.; azitromicina 500 mg v.o. 3 veces por semana; omeprazol 20 mg/24 h v.o.; cotrimoxazol 80 mg/24 h v.o.; anfotericina B liposomal 24 mg cada 14 días por vía nebulizada, y tobramicina 300 mg/12 h por vía nebulizada.
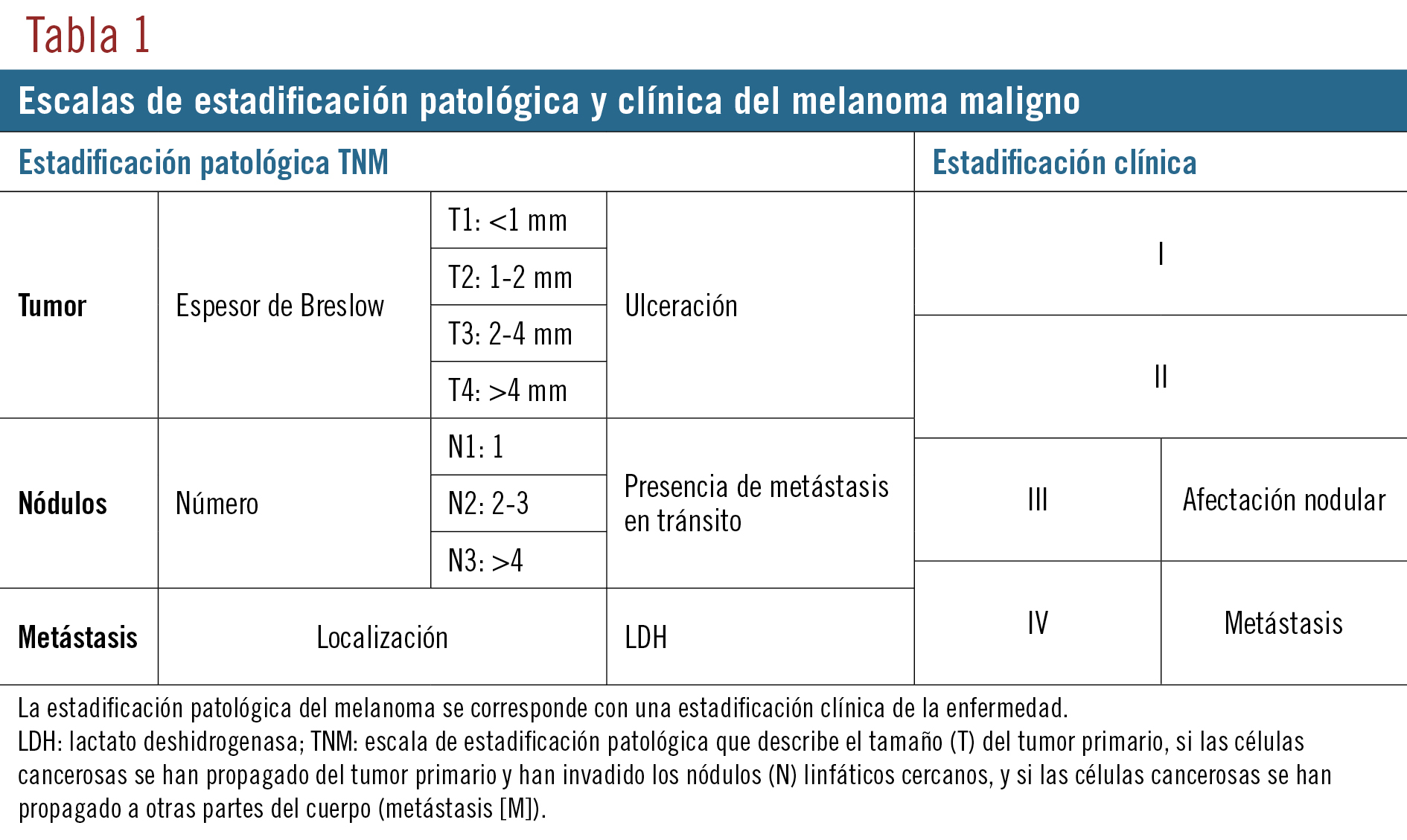
En agosto de 2017, año y medio después de la realización del trasplante, se diagnosticó a la paciente un melanoma maligno BRAF no mutado in situ, lentiginoso, localizado en la mucosa yugal y el hemilabio derecho, de 3-4 meses de evolución. En octubre de 2017 se procedió a la extirpación del tumor y a la reconstrucción con parte anterolateral del muslo. La biopsia selectiva del ganglio centinela mostró una invasión del mismo sin afectación extracapsular. No existía diseminación adenopática y se descartó la aparición de metástasis. Su estadificación patológica, siguiendo la escala TNM (tumor, nódulos, metástasis), fue T3bN1aM0 (T3: tumor de 2-4 mm con ulceración, invasión vascular, linfática y perineural, 4 mitosis por mm2 y sin regresión ni satelitosis; N1: un nódulo afectado; M0: sin metástasis), que clínicamente correspondía a un estadio IIIC9 (tabla 1). Debido al antecedente de trasplante bipulmonar y a la inmunosupresión concomitante, la paciente no era tributaria de recibir quimioterapia convencional y se trató con RT adyuvante.
Ocho meses después de finalizar la RT, en noviembre de 2018, se observaron opacidades pulmonares bilaterales en vidrio deslustrado y levemente hipermetabólicas, sugestivas de metástasis. La paciente acudió a la consulta en diciembre de 2018 para obtener los resultados de un examen de anatomía patológica realizado previamente, que confirmó una progresión de la enfermedad subcutánea y una probable metástasis pulmonar con mutación BRAF V600D+.
En ese momento, la paciente presentaba un estado general conservado, ECOG 1, sin ninguna otra sintomatología. Por su antecedente de trasplante pulmonar y por estar en tratamiento inmunosupresor activo, no era tributaria de participar en un ensayo clínico (EC) ni tampoco de recibir inmunoterapia adyuvante con nivolumab, ya que estos pacientes estaban excluidos del EC pivotal CheckMate 23813. Según las guías institucionales, la paciente era candidata a recibir tratamiento de primera línea con vemurafenib 940 mg/12 h + cobimetinib 60 mg/24 h, que inició en enero de 2019. Dado que estos fármacos –al ser sustrato de proteína ABCG2/BCRP, enzima citocromo P450 3A4 y glicoproteína P– presentan numerosas interacciones farmacológicas, desde el Servicio de Farmacia se realizó una revisión exhaustiva de las mismas y se decidió, conjuntamente con el equipo médico, sustituir acenocumarol por enoxaparina. Asimismo, dada la presencia de metástasis, la rápida progresión de la enfermedad y la implicación del uso de tacrolimús en la posible aparición de melanoma, se optó, según el balance beneficio-riesgo, por disminuir momentáneamente la dosis del inhibidor de calcineurina a unos niveles objetivo de 5-6 ng/mL y sustituir micofenolato, antimetabolito, por sirolimús, mTOR.
Tras 4 meses de tratamiento con una adecuada tolerancia, se constató una respuesta disociada en la tomografía por emisión de positrones-tomografía computarizada (PET‑TC) de control, y se comunicó a la paciente la ausencia de respuesta al tratamiento y progresión de su enfermedad de base. En este momento, tras valorar la severidad del melanoma, la afectación en su calidad de vida y el potencial de mortalidad, y teniendo presentes tanto la evidencia disponible respecto a la inmunosupresión como el riesgo/beneficio que conlleva el rechazo del injerto, se decidió suspender tacrolimús y mantener la inmunosupresión con sirolimús.
El equipo de Oncología, junto con el Servicio de Farmacia, Neumología y Dermatología, propuso una segunda línea de tratamiento con un inhibidor de los puntos de control inmunitario (immune checkpoint inhibitors [ICI]), mediante solicitud e informe clínico al comité asesor de tratamientos en situaciones especiales. Por este motivo, desde el Servicio de Farmacia se realizaron una búsqueda bibliográfica y un informe técnico de soporte, en el que se establecieron la inexistencia de alternativas terapéuticas, la inadecuación del uso combinado de ipilimumab + nivolumab por su alta toxicidad14, y la imposibilidad de inclusión de la paciente en un EC por su antecedente de trasplante bipulmonar. Dado que nivolumab es el ICI del que se dispone de más experiencia reportada en pacientes trasplantados pulmonares y renales15-18, y ante la falta de evidencia clara que ayude a inclinar la balanza hacia uno de los 2 ICI, se aprobó el uso de nivolumab en dosis de 480 mg cada 4 semanas y la paciente firmó el consentimiento informado. Respecto a la inmunosupresión, para garantizar una adecuada respuesta de nivolumab, se acuerda fijar la dosis máxima de metilprednisolona en 8 mg/24 h (equivalente a 10 mg de prednisona).
La paciente solo pudo recibir una dosis de nivolumab, ya que ingresó 1 mes más tarde con disnea y fiebre. En su momento se plantearon como diagnósticos diferenciales el rechazo del trasplante frente a la infección pulmonar frente a la reacción inmunomediada. A la espera de poder discernir entre ellos, la paciente falleció por una insuficiencia respiratoria en el contexto de una afectación metastásica pulmonar, fragilidad extrema y probable disfunción del injerto.
Discusión
Se describe el abordaje farmacoterapéutico de una paciente postrasplantada pulmonar diagnosticada de melanoma maligno metastásico tratada con nivolumab que, en este caso, falleció prematuramente.
El melanoma en estadio III, es decir, con los ganglios linfáticos regionales implicados, presenta unas tasas de supervivencia a 5 años del 78, 59 y 40% para los estadios IIIA, IIIB y IIIC, respectivamente8. El objetivo terapéutico en este grupo de pacientes consiste en la extirpación del tumor y de los nódulos afectados y en el tratamiento adyuvante, ya sea farmacológico o radioterápico, con la finalidad de evitar recaídas futuras19. El melanoma en estadio IV presenta un pronóstico infausto, con una supervivencia a 1 año del 33-62%. La elevación de los niveles de lactato deshidrogenasa (LDH) es un factor pronóstico independiente de la localización de la metástasis: los pacientes en este estadio y con niveles normales de LDH sérica presentan una supervivencia del 65% a 1 año y del 40% a los 2 años, pero si la LDH está elevada, la supervivencia es del 32 y el 18%, respectivamente8.
Durante muchos años dacarbazina (DTIC) se había considerado el tratamiento estándar de primera línea del melanoma metastásico, con tasas de respuesta del 10-20% y de corta duración (3-6 meses)19. Como agentes quimioterápicos en monoterapia, fotemustina dispone de la aprobación para su uso en caso de melanoma maligno diseminado, incluida la afectación cerebral19. El uso de temozolomida como indicación fuera de ficha técnica ha demostrado tasas de respuesta similares a las de DTIC y, debido a su capacidad de penetrar en el cerebro y otras partes del sistema nervioso, se ha utilizado en pacientes con metástasis cerebrales19. También se ha usado carboplatino y su combinación con paclitaxel o interleucina 2 (IL‑2)18. Estas terapias para el tratamiento del melanoma han quedado desplazadas por la inmunoterapia y, en pacientes con mutación BRAF V600, por la terapia dirigida con los inhibidores de la tirosina cinasa de BRAF (figura 1)19,20.
El tratamiento de elección en pacientes con melanoma metastásico BRAF mutado es la inmunoterapia (anticuerpos dirigidos frente al receptor 1 de muerte programada [anti-PD-1] o frente alantígeno 4 asociado al linfocito T citotóxico [anti-CTLA-4]), a excepción de los casos que requieran una respuesta rápida, como el aquí descrito, o que presenten una alta carga tumoral, en los que el tratamiento de elección son los inhibidores de BRAF/MEK (dabrafenib + trametinib, vemurafenib + cobimetinib o encorafenib + binimetinib)19,21.
Respecto a la inmunoterapia, en general, ipilimumab (anti-CTLA-4) presenta una mayor toxicidad. En pacientes trasplantados de órganos sólidos con neoplasias secundarias, existe controversia acerca del riesgo significativamente mayor de rechazo del injerto cuando se utiliza pembrolizumab/nivolumab (anti-PD-1), ya que parece que el receptor PD-1 tiene un papel predominante en la tolerancia inmunogénica y, por tanto, su bloqueo sería perjudicial22-25. Sin embargo, en este caso, dado que nivolumab es el ICI del que se dispone de más experiencia reportada en pacientes trasplantados pulmonares y renales15-18, y ante la falta de evidencia clara que ayude a inclinar la balanza hacia uno de los dos ICI, se optó por el uso de nivolumab.
En cuanto a la inmunosupresión, los resultados de varias publicaciones10,12 sugieren que los inhibidores de la calcineurina, tacrolimús y ciclosporina, tienen propiedades oncogénicas, principalmente vinculadas a la producción de citoquinas que promueven el crecimiento tumoral y la angiogénesis. Los niveles de inmunosupresión parecen ser el principal factor que hace aumentar el riesgo de aparición de tumores malignos postrasplante10. En cambio, diferentes estudios realizados en humanos han demostrado que los inhibidores de mTOR, como sirolimús y everolimús, ejercen efectos antineoplásicos por múltiples mecanismos: antiangiogénesis, inhibición de la replicación celular, inhibición de la interleucina 10 e inducción de la apoptosis. En este sentido, los inhibidores de mTOR han demostrado una acción preventiva en la carcinogénesis cutánea, así como propiedades antitumorales tras la aparición de tumores malignos cutáneos26. Respecto a los glucocorticoides, su uso concomitante con inmunoterapia es controvertido ya que podrían comprometer la eficacia del tratamiento. Por este motivo los EC excluyeron a los pacientes que recibían prednisona en dosis ≥10 mg/día o equivalente. Un estudio en el que se comparaban las tasas de respuesta a la inmunoterapia en pacientes que recibían dosis suprafisiológicas de glucocorticoides (>10 mg de prednisona o equivalente) frente a aquellos que no, puso de manifiesto una menor respuesta en los pacientes que recibieron dosis altas de glucocorticoides (15%) frente a los que no recibieron dosis superiores a 10 mg (44%)27.
Conclusiones
El tratamiento oncológico de los pacientes trasplantados supone un reto constante debido al manejo de las pautas de inmunosupresión crónica que reciben y al alto riesgo de rechazo. Siempre es necesario tener en cuenta el balance beneficio-riesgo en el abordaje multidisciplinario del paciente oncológico con trasplante previo de órgano sólido.
Actualmente no existen EC comparativos que permitan tomar decisiones en función de la evidencia para el tratamiento oncológico en pacientes trasplantados. La inmunoterapia ofrece nuevas alternativas de tratamiento en los melanomas avanzados; sin embargo, por su mecanismo de acción, puede suponer un riesgo para la viabilidad del injerto, y sus reacciones adversas son complejas. Por ello, aunque es necesario minimizar la inmunosupresión para asegurar una buena respuesta tumoral a la inmunoterapia, es imprescindible valorar el riesgo de rechazo que esta estrategia supone. n
Bibliografía
1. Pampena R, Kyrgidis A, Lallas A, Moscarella E, Argenziano G, Longo C. A meta-analysis of nevus-associated melanoma: Prevalence and practical implications. J Am Acad Dermatol. 2017; 77(5): 938-945.e4 [DOI: 10.1016/j.jaad.2017.06.149] [Epub 2017 Aug 29. PMID: 28864306].
2. Chang AE, Karnell LH, Menck HR. The National Cancer Data Base report on cutaneous and non-cutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 1998; 83(8): 1.664-1.678 [DOI: 10.1002/(sici)1097-0142(19981015)83:8<1664:aid-cncr23>3.0.co;2-g] [PMID: 9781962].
3. Garbe C, Blum A. Epidemiology of cutaneous melanoma in Germany and worldwide. Skin Pharmacol Appl Skin Physiol. 2001; 14(5): 280-290 [DOI: 10.1159/000056358] [PMID: 11586069].
4. Sacchetto L, Zanetti R, Comber H, Bouchardy C, Brewster DH, Broganelli P, et al. Trends in incidence of thick, thin and in situ melanoma in Europe. Eur J Cancer. 2018; 92: 108-118 [DOI: 10.1016/j.ejca.2017.12.024] [Epub 2018 Jan 31. PMID: 29395684].
5. Ríos L, Nagore E, López JL, Redondo P, Martí RM, Fernández-de-Misa R, et al. Melanoma characteristics at diagnosis from the Spanish National Cutaneous Melanoma Registry: 15 years of experience. Actas Dermosifiliogr. 2013; 104(9): 789-799. [DOI: 10.1016/j.ad.2013.02.003] [Epub 2013 Apr 25. PMID: 23622931].
6. Pronóstico del melanoma: tasas de supervivencia y mortalidad. Asociación Española Contra el Cáncer, 2021 [consultado el 23 de enero de 2021]. Disponible en: https://www.aecc.es/es/todo-sobre-cancer/tipos-cancer/cancer-piel/melanoma/pronostico-supervivencia
7. Olsen CM, Thompson JF, Pandeya N, Whiteman DC. Evaluation of sex-specific incidence of melanoma. JAMA Dermatol. 2020; 156(5): 553-560 [DOI: 10.1001/jamadermatol.2020.0470] [Erratum in: JAMA Dermatol. 2020; 156(5): 604] [PMID: 32211827; PMCID: PMC7097866].
8. Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol. 2009; 27(36): 6.199-6.206 [DOI: 10.1200/JCO.2009.23.4799] [Epub 2009 Nov 16] [PMID: 19917835; PMCID: PMC2793035].
9. Risk factors for melanoma skin cancer. American Cancer Society, 2019 [consultado el 23 de marzo de 2021]. Disponible en: https://www.cancer.org/cancer/melanoma-skin-cancer/causes-risks-prevention/risk-factors.html
10. Koff JL, Waller EK. Improving cancer-specific outcomes in solid organ transplant recipients: where to begin? Cancer. 2019; 125(6): 838-842 [DOI: 10.1002/cncr.31963] [Epub 2019 Jan 9. PMID: 30624770].
11. Gerlini G, Romagnoli P, Pimpinelli N. Skin cancer and immunosuppression. Crit Rev Oncol Hematol. 2005; 56(1): 127-136 [DOI: 10.1016/j.critrevonc.2004.11.011] [PMID: 15978830].
12. Mendoza IA, García C, Segura CB. Skin cancer in solid-organ transplant recipients. Dermatologia CMQ. 2014; 12(1): 58-71.
13. Ascierto PA, Del Vecchio M, Mandalá M, Gogas H, Arance AM, Dalle S, et al. Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol. 2020; 21(11): 1.465-1.477 [DOI: 10.1016/S1470-2045(20)30494-0] [Epub 2020 Sep 19. PMID: 32961119].
14. Larkin J, Chiarion-Sileni V, González R, Grob JJ, Cowey CL, Lao CD, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med. 2015; 373(1): 23-34.
15. Abdel-Wahab N, Safa H, Abudayyeh A, Johnson DH, Trinh VA, Zobniw CM, et al. Checkpoint inhibitor therapy for cancer in solid organ transplantation recipients: an institutional experience and a systematic review of the literature. J Immunother Cancer. 2019; 7(1): 106 [DOI: 10.1186/s40425-019-0585-1] [Erratum in: J Immunother Cancer. 2019; 7(1): 158] [PMID: 30992053; PMCID: PMC6469201].
16. Kittai AS, Oldham H, Cetnar J, Taylor M. Immune checkpoint inhibitors in organ transplant patients. J Immunother. 2017; 40(7): 277-281 [DOI: 10.1097/CJI.0000000000000180] [PMID: 28719552].
17. Ros J, Matos I, Martin-Liberal J. Immunotherapy in organ-transplanted cancer patients: efficacy and risk of organ rejection. Ann Oncol. 2019; 30(7): 1.173-1.177 [DOI: 10.1093/annonc/mdz129] [PMID: 30977776].
18. Regalla DKR, Williams GR, Paluri RK. Immune checkpoint inhibitors in the management of malignancies in transplant recipients. Postgrad Med J. 2018; 94(1118): 704-708 [DOI: 10.1136/postgradmedj-2018-136081] [Epub 2018 Nov 13. PMID: 30425139].
19. Informe tècnic del Consell Assessor de la Medicació Hospitalària de Dispensació Ambulatòria (CAMHDA). Tractament en monoteràpia de pacients adults amb melanoma avançat (irresecable o metastàtic) [consultado el 8 de abril de 2021]. Disponible en: https://catsalut.gencat.cat/web/.content/minisite/catsalut/proveidors_professionals/medicaments_farmacia/harmonitzacio/informes/pembrolizumab/Informe-pembrolizumab.pdf
20. Haas L, Wiesner T, Obenauf AC. A new era of proactive melanoma therapy: hit hard, hit early. Br J Dermatol. 2018; 178(4): 817-820 [DOI: 10.1111/bjd.16347] [PMID: 29668089].
21. National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines®). Melanoma: cutaneous. v.2.2021[consultado el 8 de abril de 2021]. Disponible en: https://www.nccn.org/professionals/physician_gls/pdf/cutaneous_melanoma.pdf
22. Riella LV, Paterson AM, Sharpe AH, Chandraker A. Role of the PD‑1 pathway in the immune response. Am J Transplant. 2012; 12(10): 2.575-2.587 [DOI: 10.1111/j.1600-6143.
2012.04224.x] [Epub 2012 Aug 17. PMID: 22900886; PMCID: PMC3784243].
23. Johnson DB, Sullivan RJ, Menzies AM. Immune checkpoint inhibitors in challenging populations. Cancer. 2017; 123(11): 1.904-1.911 [DOI: 10.1002/cncr.30642] [Epub 2017 Feb 27. PMID: 28241095; PMCID: PMC5445005].
24. Tanaka K, Albin MJ, Yuan X, Yamaura K, Habicht A, Murayama T, et al. PDL1 is required for peripheral transplantation tolerance and protection from chronic allograft rejection. J Immunol. 2007; 179(8): 5.204-5.210 [DOI: 10.4049/jimmunol.179.8.5204] [PMID: 17911605; PMCID: PMC2291549].
25. Menzies AM, Johnson DB, Ramanujam S, Atkinson VG, Wong ANM, Park JJ, et al. Anti-PD-1 therapy in patients with advanced melanoma and preexisting autoimmune disorders or major toxicity with ipilimumab. Ann Oncol. 2017; 28(2): 368-376 [DOI: 10.1093/annonc/mdw443] [PMID: 27687304].
26. Knoll GA, Kokolo MB, Mallick R, Beck A, Buenaventura CD, Ducharme R, et al. Effect of sirolimus on malignancy and survival after kidney transplantation: systematic review and meta-analysis of individual patient data. BMJ. 2014; 349: g6679 [DOI: 10.1136/bmj.g6679] [Erratum in: BMJ. 2014; 349: g7543] [PMID: 25422259; PMCID: PMC4241732].
27. Arbour KC, Mezquita L, Long N, Rizvi H, Auclin E, Ni A, et al. Impact of baseline steroids on efficacy of programmed cell death-1 and programmed death-ligand 1 blockade in patients with non-small-cell lung cancer. J Clin Oncol. 2018; 36(28): 2.872-2.878 [DOI: 10.1200/JCO.2018.79.0006] [Epub 2018 Aug 20. PMID: 30125216].